Latihan 3
Buatlah 4 soal pilihan ganda dari tugas kelompok anda
(A) 496, 4.560, dan 6.900(B) 578, 1.820, dan 2.750(C) 736, 1.450, dan 7.730(D) 786, 1.580, dan 3.230(E) 1.012, 1.904, dan 2.190
Na merupakan unsur yang terletak pada golongan 1A dengan konfigurasi elektron 1s2 2s2 2p6 3s1 (2-8-1). Stabil ketika ia melepaskan elektron pertama (membentuk Na+) konfigurasi elektron Na 2-8.
Bila suatu spesi stabil (biasa elektron valensinya 8 seperti pada Na+) maka diperlukan energi yang besar untuk melepaskan lagi elektron yang dimiliki. Ini ditandai dengan energi ionisasi yang melonjak sangat besar dari sebelumnya.
(A) 496, 4.560, 6.900, 9.540(B) 578, 1.820, 2.750, 11.600(C) 738, 1.450, 7.730, 10.500(D) 786, 1.580, 3.230, 4.360(E) 1.022, 1.904, 2.910, 4.960
Jawaban : B
Karena Al stabil setelah melepaskan 3 elektron (ditandai dengan muatan 3+ saat membentuk senyawa) maka untuk melepaskan elektron keempat energi ionisasinya menjadi sangat besar, melonjak, naik drastis, dari energi ionisasi ketiga ke energi ionisasi keempat.
3.Tentukan atom mana yang memiliki afinitas elektron paling besar!
A. Terdapat di alam dalam keadaan bebas.
B. Persenyawaannya mudah larut dalam air.
C. Sangat lunak sehingga mudah diiris dengan pisau.
D. Unsur-unsur yang sangat reaktif.
E. Reduktor air yang sangat baik.
Jawaban : A
Pembahasan
Sifat Alkali tanah
pertama logam alkali bersifat sangat reaktif. Sifatnya yang reaktif ini membuat logam alkali tidak pernah ditemukan di alam bebas. Sifat kedua ialah memiliki titik leleh yang rendah.ur kimia lainnya. Mudahnya bereaksi itu disebabkan sifatnya reaktif. Selain itu, logam alkali sangat mudah larut di dalam air.Lalu, logam alkali berbentuk padatan, kecuali sesium yang berbentuk cair, dan memiliki karakteristik lunak. Saking lunaknya, padatan logam alkali dapat diiris dengan pisau seperti laiknya lilin atau sabun.
Quiz 3
Buatlah 2 soal (per chapter) pilihan ganda dari tugas kelompok lain
Chapter 1
1. Kelompok zat-zat di bawah ini yang merupakan unsur yaitu . . . .
a. raksa, hidrogen, dan udara
b. natrium, karbon, dan fosfor
c. air, besi, dan tembaga
d. alkohol, air, dan minyak
Jawaban : B
Pembahasan
Sifat karena natrium hidrogen dan fosfor merupakan unsur tunggal,bukan unsur yang sudah di campur sehingga menjadi sebuah senyawa.
2. Lambang unsur nikel, kalsium, dan timah berturut-turut dituliskan . . . .
a. Ni, Ca, dan Pb
b. N, Ca, dan Pb
c. N, K, dan Th
d. Ni, Ca, dan Sn
Jawaban : D
Pembahasan
Pada pemberian nama senyawa diambil huruf pertama nama senyawa dengan huruf besar.jika unsur lain sudah memakai nama awalnya maka diambil 2 huruf dan huruf ke-2 merupakan huruf kecil.
Chapter 2
1. Kalium mempunyai nomor atom 19 dan nomor massa 39. Jumlah elektron pada ion Kalium adalah . . .
A. 21
B. 20
C. 19
D. 18
E. 17
Jawaban : C
Pembahasan
Pa Jumlah elektron sama dengan jumlah NO atom jika senyawa tersebut bukan unsur yang bermuatan + dan - , jika merupakan unsur yang bermuatan maka harus di hitung ulang.
2. Pada isotop unsur ![]() , jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
, jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
A. (26 , 26) : (88 , 88)
B. (26 , 26) : (88 , 138)
C. (26 , 30) : (88 , 138)
D. (26 , 30) : (88 , 266)
E. (26 , 56) : (88 , 138)
Jawaban : C
Pembahasan
Fe
No atom = proton = 26
Netron = No Massa-No atom = 30
Ra
No atom = proton = 88
Netron = No Massa-No atom = 138
Chapter 3
2Al + 3H2SO4 > Al2(SO4)3 + 3H2
langsung saja gunakan perbandingan mol
2Al + 3H2SO4 > ........(reaksi masih sama)
0.1mol----0.15mol
Mol Al didapat dari m/mr = 2,7/27 =0,1mol, kemudian bandingkan dengan koefisien.
Maka [H2SO4] = n / v
M = 0,15 / 0,5
M = 0,3 mol/L
Jawaban : C
Pembahasan
n Ca =
6 =
a Ca = 240 gram
Chapter 4
1. Menurut teori asam-basa Bronsted-Lowry, asam didefinisikan sebagai zat yang . . . .
a. Meningkatkan [H+] bila dimasukkan kedalam H2O
b. Menurunkan [H+] bila dimaasukkan kedalam H2O
c. Meningkatkan [OH–] bila dimasukkan kedalam H2O
d. Menerima 1 H+ dari pasangan reaksinya
e. Memberi 1 H+ dari pasangan reaksinya
Jawaban: E
Pembahasan
Konsep asam basa menurut Bronsted-Lowry berkaitan dengan ion H+ atau proton. Zat yang memiliki kecenderungan untuk menyumbangkan ion H+ (proton) pada zat lain adalah asam. Mereka juga dikenal sebagai donor proton
2. Nilai bilangan okidasi dari S didalam Na2SO3 adalah . . .
a. 4
b. 5
c. 6
d. 7
e. 8
Jawaban : A
Pembahasan
(jumlah atom Na x biloks atom Na) + (jumlah atom S x biloks atom S) + (jumlah atom O x biloks atom O) = 0
(2 x 1) + (1 x biloks S) + (3x (-2)) = 0
2 + Biloks S - 6 = 0
Biloks S= 6-2
Biloks S = +4
Chapter 5
1. Suatu gas ideal mula-mula menempati ruang yang volumenya V pada suhu T dan tekanan P. Jika suhu gas menjadi 3/2 T dan tekanannya menjadi 2 P, maka volume gas menjadi ….
A. 3/4 V
B. 4/3 V
C. 3/2 V
D. 3 V
E. 4 V
Jawaban : A
Pembahasan
p’ = 2p
T’ = 3/2 T
Karena gas jumlahnya tetap sama maka n juga tetap.
Sehingga:
pV / nRT = p’V’ / nRT’
pV / T = p’V’ / T’
V’ = pVT’ / p’T
= pV(3/2T)/ 2pT
= V(3/2)/2
= ¾ V
2. Tekanan gas dalam ruang tertutup:
- 1) Sebanding dengan kecepatan rata-rata partikel gas.
- 2) Sebanding dengan energi kinetik rata-rata partikel gas.
- 3) Berbanding terbalik dengan volume gas.
- 4) Tidak bergantung pada banyaknya partikel gas.
Pernyataan yang benar adalah…
A. 1, 2, dan 3
B. 1, 2, 3, dan 4
C. 1 dan 3
D. 2 dan 4
E. 4 saja
Jawaban: A
Chapter 6
1. Suatu campuran pereaksi di dalam tabung reaksi meyebabkan tabung tersebut menjadi panas jika dipegang. Penyataan yang tepat mengenai hal tersebut adalah….
a. Entalpi pereaksi bertambah
b. Entalpi peraksi berkurang
c. Entalpi pereaksi dan hasil reaksi bertambah
d. Entalpi pereaksi lebih besar daripada entalpi hasil reaksi
e. Entalpi hasil reaksi lebih besar daripada entalpi pereaksi
Jawaban: D
2. Jika diketahui:
![]()
Perubahan entalpi pada penguraian 1 mol gas NH3 menjadi unsur-unsurnya adalah….
a. -92 kJ
b. -46 kJ
c. +46 kJ
d. + 184 kJ
e. + 92 kJ
Jawaban : C
Pembahasan
ΔH°d = - ΔH°f
maka reaksi menjadi :
2NH3 (g) ---> N2 (g) + 3H2 (g) ΔH = +92 kJ (karena reaksi dibalik maka tanda ΔH juga dibalik).
sedangkan untuk penguraian 1 mol maka persamaan reaksi di kali 1/2, maka perubahan entalpi juga dikalikan 1/2.
NH3 (g) ---> 1/2 N2 (g) + 3/2 H2 (g) ΔH°d = +46 kJ/mol
Chapter 7
1. Pada isotop unsur ![]() , jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
, jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
A. (26 , 26) : (88 , 88)
B. (26 , 26) : (88 , 138)
C. (26 , 30) : (88 , 138)
D. (26 , 30) : (88 , 266)
E. (26 , 56) : (88 , 138)
Jawaban : C
Pembahasan
Fe
No atom = proton = 26
Netron = No Massa-No atom = 30
Ra
No atom = proton = 88
Netron = No Massa-No atom = 138
2. Nomor atom dari unsur X adalah…
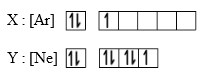
A. 17
B. 18
C. 21
D. 26
E. 30
Jawaban : C
Pembahasan
Jumlah elektron Ar sebagai unsur paling stabil berjumlah 18 dan di tambah e elektron dari kotak, 2 menghadap ke atas dan 1 menghadap kebawah.
Chapter 9
1. Diantara sifat berikut ini yang bukan sifat senyawa ion adalah …
a. Rapuh
b. Titik leleh tinggi
c. Larutan dapat menghantar listrik
d. Lelehannya dapat menghantar listrik
e. Padatannya dapat menghantar listrik
Jawaban : D
Pembahasan
Sifat senyawa ion, yaitu:
- Kristalnya keras tetapi rapuh
- Mempunyai titik lebur dan titik didih yang tinggi
- Mudah larut di dalam air
- Dapat menghantar arus listrik dalam keadaaan cair dan larutan, tetapi dalam padatan tidak bisa.
2. Diketahui nomor atom unsur:
A= 3 D= 12
B= 4 E= 9
C= 11 F= 17
Ikatan paling ionic dapat terbentuk antara ….
a. A dengan E
b. A dengan F
c. C dengan E
d. C dengan F
e. B dengan F
Jawaban: C
Pembahasan
Konfigurasi electron pada soal ini yaitu:
3A= 2 1 12D= 2 8 2
4B= 2 2 9E= 2 7
11C= 2 8 1 17F= 2 8 7
Pada konfigurasi yang ikatan ionic paling kuat yaitu yang bisa mencapai kestabilan sesuai dengan kaidah octet, yang menurut G. N. Lewis dan W. Kossel, kestabilan unsur gas mulia disebabkan oleh electron valensinya yang berjumah delapan, keculi He yang hanya memiliki dua electron.
Sehingga didapatkan jawabannya yaitu C dengan F, yang unsur C melepas satu electron sedangkan yang unsur F menerima satu electron agar stabil.
Chapter 10
1. Molekul H2O mempunyai momen dipol dan bersifat polar.
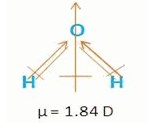
Ikatan kimia yang terdapat dalam senyawa H2SO4 adalah . . .
a. 2 ikatan kovalen tunggal dan 3 ikatan kovalen koordinasi
b. 3 ikatan kovalen rangkap dan 2 ikatan ion
c. 2 ikatan ion dan 3 ikatan kovalen koordinasi
d. 4 ikatan kovalen tunggal dan 2 ikatan kovalen koordinasi
e. 2 ikatan kovalen tunggal dan 3 ikatan ion
Jawaban : D
Pembahasan
pada penggambaran struktur Lewis molekul H2SO4, elektron yang berasal dari atom H ditandai dengan (●), elektron dari atom S ditandai dengan (●), dan atom O ditandai dengan (x).
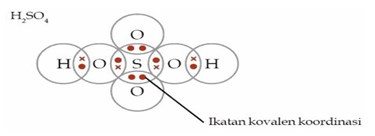
Jadi, dalam molekul H2SO4 terdapat empat ikatan kovalen tunggal dan dua ikatan kovalen koordinasi.
2. Yang dimaksud dengan ikatan kovalen polar….
a. terjadi jika adanya penggunaan pasangan electron secara bersama-sama oleh atom-atom yang berikatan
b. Ikatan kovalen yang terbentuk ketika electron sekutu atom tidak benar-benar dipakai
c. Ikatan kovalen yang terbentuk ketika atom membagikan elektronnya setara (sama)
d. Ikatan kimia yang yang menggunakan pasangan electron bersama yang berasal dari salah satu atom
e. Ikatan yang terbentuk karena adanya serah terima electron
Jawaban : B
Pembahasan
Ikatan kovalen terbentuk karena ketika electron sekutu atom tidak benar-benar dipakai. Hal ini terjadi ketika atom mempunyai elektronegativitas yang lebih tinggi dari pada atom laiinya.
Atom yang mempunyai elektronegativitas yang tinggi mempunyai tarikan electron yang lebih kuat. Akibatnya electron sekutu lebih dekat ke atom yang mempunyai elektronegatifitas tinngi.
Chapter 11
1. Antarmolekul diatomik dapat membentuk gaya antarmolekul karena adanya gaya London. Sesuai dengan faktor-faktor yang mempengaruhi gaya London, antarmolekul diatomik berikut yang memiliki gaya van der Waals paling kuat adalah ….
a. H2 dan N2
b. N2 dan Cl2
c. H2 dan Cl2
d. N2 dan O2
e. Cl2 dan O2
Jawaban : E
Pembahasan
H2 jumlah elektron 2, N2 jumlah elektron 14, O2 jumlah elektron 16, Cl2 jumlah elektron 34, berdasarkan data tersebut dapat disimpulkan bahwa titik didih dipengaruhi oleh jumlah elektron.
Semakin banyak jumlah elektron maka gaya tarik-menarik molekul dipol sesaat semakin besar sehingga ikatannya semakin kuat. Mudah tidaknya suatu molekul membentuk dipol sesaat dinamakan polarisabilitas.
1. Sifat koligatif larutan adalah sifat yang bergantung pada ….
a. Jenis zat terlarut
b. Jenis zat pelaut
c. Jumlah zat pelarut
d. Jumlah zat terlarut
e. Konsentrasi larutan
Jawaban : D
Pembahasan
Sifat koligatif larutan adalah sifat larutan yang tidak bergantung pada jenis zat terlarut tetapi hanya bergantung pada konsentrasi partikel zat terlarutnya. Sifat koligatif larutan terdiri dari dua jenis, yaitu sifat koligatif larutan elektrolit dan sifat koligatif larutan nonelektrolit.
2. Dalam penurunan tekanan uap ) semakin tinggi temperatur maka ….
a. Semakin besar tekanan uap zat cair
b. Sama dengan tekanan uap zat cair
c. Semakin rendah tekana uap zat cair
d. Tekanan uap tidak berpengaruh
e. Tidak ada tekanan uapnya
Jawaban : A
Pembahasan
Penurunan tekanan uap larutan merupakan salah satu sifat koligatif larutan yaitu sifat larutan yang tergantung pada jumlah zat terlarut. Semakin tinggi suhu, semakin besar tekanan uap. Karena semakin besar suhunya, maka zat pelarut akan semakin cepat menguap.


Tidak ada komentar:
Posting Komentar